1. 什么是原料药 Active Pharmaceutical Ingredient?
ICH Q7A的定义:
英文直译:活性药用成分,缩写:API
旨在用于药品制造中的任何一种物质或物质的混合物,而且在用于制药时,成为药品的一种活性成分。此种物质在疾病的诊断,治疗,症状缓解,处理或疾病的预防中有药理活性或其它直接作用,或者能影响机体的功能和结构。
ICH Q7A的定义:
用来表示中间体或原料药的生产中要用的起始物料、试剂和溶剂的通用专业名词。
2、什么是中间体 Intermediate?
ICH Q7A的定义:
原料药工艺步骤中产生的、必须经过进一步分子变化或精制才能成为原料药的一种物料。中间体可以分离或不分离。
(注:ICH Q7指南只涉及该公司定义为原料药生产起始点以后生产的中间体。)
3、什么是原料药起始物料 API Starting Material?
ICH Q7A 定义:
是指一种原料、中间体或API,用来生产一种API,并以重要结构片段的形式结合到API结构中。API的起始物料可能是在市场上有售、能够通过合同或商业协议从一个或多个供应商处购得,或由生产厂家自制。API的起始物料一般来说有明确的化学特性和结构。
那么,如何定义“重要结构片段”?
是指分子结构中对API分子的药理活性有贡献或是有重要意义的部分( ICH Q7A US问与答)
它常被申报人错误地解释为原料药结构相近的片段,适用于对原料药最终分子结构有贡献的物料,与试剂、催化剂或溶剂是相对的。(EMA 针对ICH Q11反思报告 注释5)
4、API起始物料与GMP适用范围
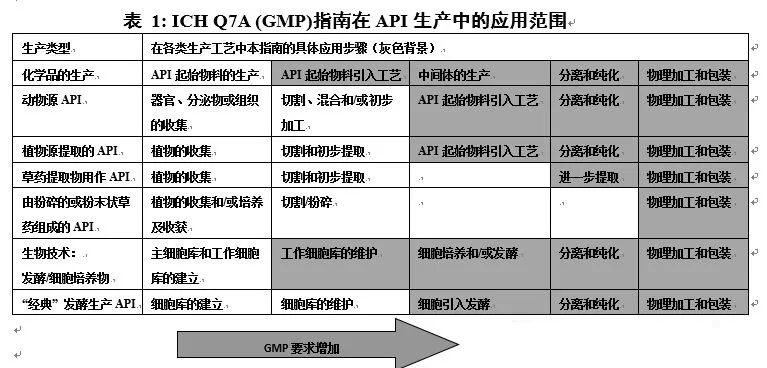
5、工艺流程与起始物料选择
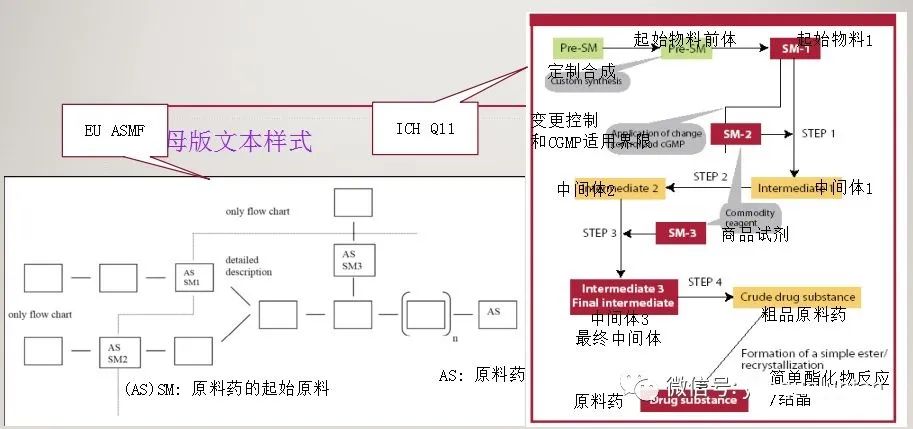
6、工艺流程与注册申报范围
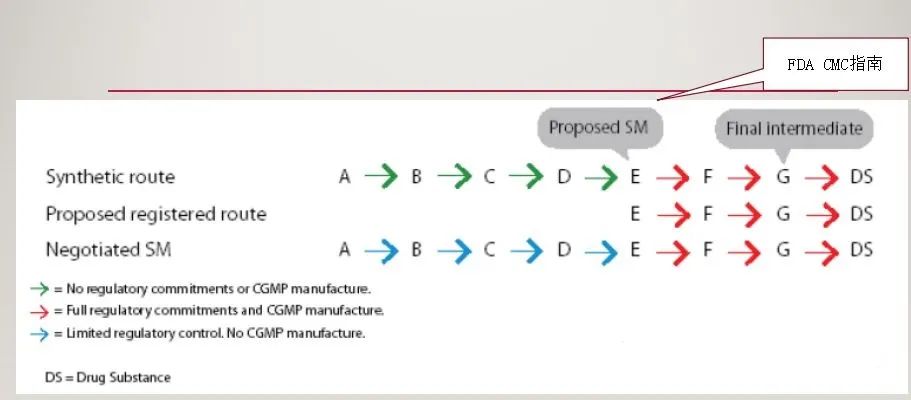
7、为什么要关注原料药起始物料
A、ICH注册指南要求
1)ICH Q7,原料药GMP指南,2000年11月10日批准实施
定义了什么是原料药起始物料,并规定“从起始物料的引入开始,中间体和原料药的生产,应遵守GMP的规范”。
但该文件没有规定如何选择起始物料。
2)ICH Q11,原料药的开发和生产, 2012年5月1日批准实施
对应如何选择起始物料和申报时应提交的信息提供了指导原则。
B、欧盟药品注册法规要求
1)CHEMISTRY OF ACTIVE SUBSTANCES,原料药化学指南,1987年10月
2)CPMP/QWP/130/96, Rev 1,新原料药化学指南,2003年12月1日
3)EMA/CHMP/QWP/96664/2015 ,原料药化学指南(草案)(替代1和2),2015年2月13日
上述三个指南,规定了应如何编写原料药申报的技术资料(ASMF),包含了起始物料应提交哪些内容。
4) EMA/448443/2014,化学原料药生产起始物料的选择和论证要求思考,2014年9月12日,欧洲药品管理局( EMA )针对ICH Q11发布了该反思报告,以澄清EMA对如何选择起始物料的看法。
5)PA/PH/CEP (04) 2, 6R,CEP修订和更新要求指南, EDQM(欧洲药典委员会)于2014年7月发布,载明起始物料发生变更应提交哪些资料。
6)EDQM发布的新CEP申请10大缺陷,第1名,起始物料资料信息不充分(合成路线,杂质谱,如有关物质、试剂、溶剂、催化剂,携带至成品中的杂质),第3名,起始物料质量标准不合适(特别易携带至成品的有关物质和残留溶媒)
C、FDA CMC指南要求
1)美国第II类原料药DMF完整性评估,2016年2月,美国FDA发布的行业指南中,规定了起始物料应提供哪些资料(明确要求按照ICH Q11原则选择起始物料,并提供理由阐述)
2) FDA行业指南,已批准上市NDA/ANDA的年度报告,对起始物料的质量标准和分析方法相关的变更分类有规定。
D、WHO PQ注册要求
1)WHO TRS No.957 Annex 4,WHO APIMF指南,包含了起始物料的选择和控制应提交的资料。
E、国内药政注册要求
1)新注册分类4、5.2类申报资料要求(试行)- CTD指南,中国国家食品药品监督管理局,2016年第80号通告的附件,更新细化了起始物料应提交资料的规定,起始物料的选择应符合ICH Q11和欧盟的相关要求。
2)CDE 审核缺陷:
S2.1是否为粗品精制制备原料药,
S2.2是否采用游离酸/碱经一步成盐精制制备原料药,
S2.3 I类溶剂的使用是否是必须的
2)CDE 审核缺陷:
2.4.1是否提供了重要起始物料的制备工艺
2.4.2是否制订了重要起始物料的内控标准
声明:本网站所有转载文章系出于传递更多信息之目的,并已标明来源,转载内容不代表本站立场。如果所转载文章的版权方不希望被转载,可与我们联系,我们将立即进行删除处理。









